Щелочные и солевые элементы (батарейки) обычно используются для питания различных электронных устройств, радиоаппаратуры, игрушек, а литиевые элементы чаще всего встречаются в портативных медицинских приборах, таких как глюкометры, или в цифровой технике, например, в фотоаппаратах.
Гальванические элементы – структура, принцип действия, типы и основные свойства
Предпосылки для появления гальванических элементов. Немного истории. В 1786 году итальянский профессор медицины, физиолог Луиджи Алоизио Гальвани обнаружил интересное явление: мышцы задних лапок только что разобранной тушки лягушки, подвешенной на медных крючках, сокращались, когда ученый прикасался к ним стальным скальпелем. Гальвани сразу же пришел к выводу, что это проявление “животного электричества”.
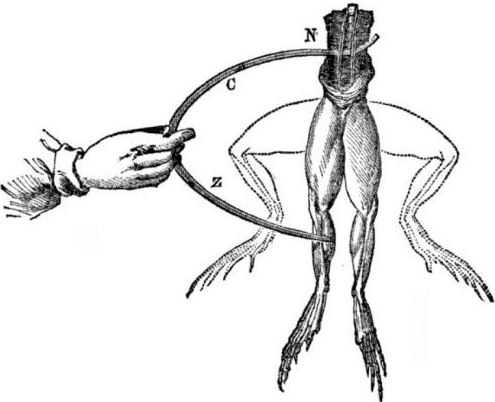
После смерти Гальвани его ровесник Алессандро Вольта, химик и физик, описал и публично продемонстрировал более реалистичный механизм возникновения электрического тока при контакте различных металлов.
Вольта, проведя серию экспериментов, пришел к однозначному выводу, что ток возникает в цепи из-за наличия двух проводников из разных металлов, помещенных в жидкость, и это не “животное электричество”, как считал Гальвани. Вибрация лапок лягушки была результатом тока, возникающего при контакте различных металлов (медных крючков и стального скальпеля).
Вольта продемонстрировал те же явления, которые Гальвани продемонстрировал на мертвой лягушке, но на совершенно неживом бытовом электрометре, и дал точное объяснение появлению электричества в 1800 году: “проводник второго класса (жидкость) находится в центре и в контакте с двумя проводниками первого класса из двух разных металлов…. Следствием этого является электрический ток в одном или другом направлении”.

В одном из своих первых экспериментов Вольта опустил две пластины – цинковую и медную – в банку с кислотой и соединил их проволокой. Затем цинковая пластина начала растворяться, и на медной пластине образовались пузырьки газа. Вольта предположил и доказал, что электричество течет по проводу.
Он изобрел ячейку Вольта – первый гальванический элемент. Вольта превратил его в вертикальный цилиндр (столб), состоящий из колец цинка, меди и пропитанной кислотой ткани. Вольтаический столб длиной полметра вырабатывал напряжение, чувствительное для человека.
Поскольку именно Луиджи Гальвани был инициатором исследований, запомнилось и название этого химического источника электричества.
Гальванический элемент – это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, в результате чего в замкнутой цепи возникает электрический ток. Таким образом, в гальванических элементах химическая энергия преобразуется в электрическую.
Гальванические элементы сегодня

Гальванические элементы сегодня называют батареями. Существует три типа батарей: солевые (сухие элементы), щелочные (также называемые алкалиновыми) и литиевые. Принцип действия такой же, как и описанный Вольта в 1800 году: два металла взаимодействуют через электролит, и во внешней замкнутой цепи возникает электрический ток.
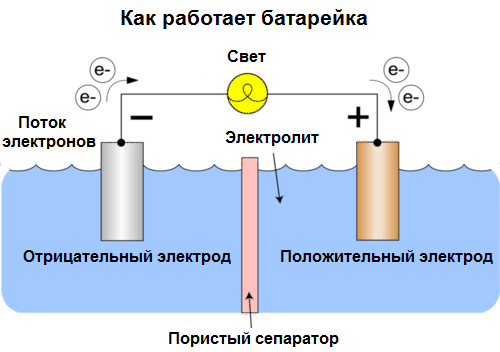
Напряжение батареи зависит как от используемых металлов, так и от количества элементов в “батарее”. Батареи, в отличие от аккумуляторов, не способны к регенерации, поскольку они напрямую преобразуют химическую энергию, т.е. энергию составляющих реагентов (восстановителей и окислителей) в электрическую энергию.
Реагенты, содержащиеся в батарее, расходуются во время ее работы, ток постепенно уменьшается, так что работа источника заканчивается, когда реагенты полностью прореагировали.
Щелочные и солевые элементы (батарейки) обычно используются для питания различных электронных устройств, радиоаппаратуры, игрушек, а литиевые батарейки чаще всего встречаются в портативных медицинских устройствах, таких как мониторы глюкозы в крови, или в цифровых устройствах, таких как фотоаппараты.

Солевые батареи
Марганцево-цинковые элементы, известные как солевые батареи, представляют собой “сухие” гальванические элементы без жидкого раствора электролита внутри.
Цинковый (+) электрод представляет собой чашеобразный катод, а анод – порошкообразную смесь диоксида марганца и графита. Ток проходит через графитовый стержень. В качестве электролита используется паста из раствора хлорида аммония, в которую добавляется крахмал или мука для загущения, чтобы ничего не вытекало.
Обычно производители батарей не указывают точный состав солевых элементов, но солевые батареи являются самыми дешевыми и обычно используются в устройствах, где потребление энергии очень низкое: часы, пульты дистанционного управления, электронные термометры и т.д.

Термин “номинальная емкость” редко используется для описания марганцево-цинковых батарей, поскольку их емкость сильно зависит от условий эксплуатации. Основным недостатком этих элементов является большое падение напряжения при разряде и значительное снижение емкости при увеличении тока разряда. Окончательное напряжение разряда устанавливается в диапазоне от 0,7 В до 1,0 В в зависимости от нагрузки.
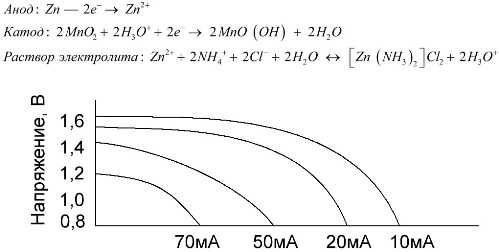
Важна не только величина разрядного тока, но и распределение нагрузки во времени. При прерывистых разрядах при высоких и средних токах срок службы батареи значительно увеличивается по сравнению с непрерывной работой. Однако при низких токах разряда и прерывистой работе в течение многих месяцев емкость может уменьшиться из-за саморазряда.
На графике выше показаны кривые разряда средней солевой батареи в течение 4, 10, 20 и 40 часов по сравнению с щелочной батареей, которая описана ниже.
Алкалиновые батарейки
Щелочная батарея – это марганцево-цинковый элемент, в котором в качестве катода используется диоксид марганца, в качестве анода – порошок цинка, а в качестве электролита – щелочной раствор, обычно в виде пасты гидроксида калия.
Эти батареи имеют ряд преимуществ – в частности, они обладают гораздо большей емкостью, лучше работают при низких температурах и при более высоких токах нагрузки.

Щелочные батарейки могут отдавать больший ток в течение более длительного периода времени по сравнению с солевыми батарейками. Более высокий ток возможен потому, что цинк используется не в чашке, а в виде порошка, который имеет большую площадь контакта с электролитом. В качестве электролита используется гидроксид калия в виде пасты.
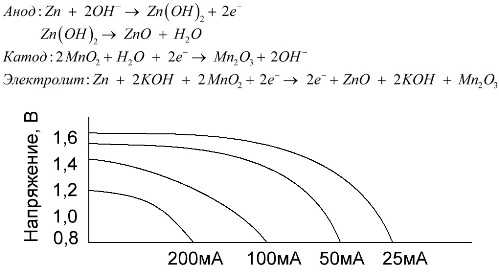
Именно благодаря способности этого типа элементов питания непрерывно отдавать большой ток (до 1 А) щелочные батареи наиболее широко используются сегодня.
В электрических игрушках, портативном медицинском оборудовании, электронных устройствах, фотоаппаратах – щелочные батарейки используются повсеместно. Они служат в 1,5 раза дольше щелочных батарей при низком токе разряда. На графике показаны кривые разряда при различных токах для сравнения с солевой батареей (см. выше) в течение 4, 10, 20 и 40 часов.
Литиевые батареи
Литиевые батареи – это еще один распространенный тип электролитических элементов – одиночный, неперезаряжаемый электролитический элемент, анодом которого является литий или его соединения. Они имеют высокую разность потенциалов из-за используемого щелочного металла.

Катод и электролит в литиевом элементе могут быть самыми разными, поэтому термин “литиевый элемент” относится к группе элементов с одинаковым материалом анода. Например, в качестве катода могут быть использованы диоксид марганца, монофторид углерода, пирит, тионилхлорид и т.д.
Литиевые батареи отличаются от других батарей очень долгим сроком службы и высокой ценой. В зависимости от размера и используемых химических материалов, литиевые батареи могут выдавать напряжение от 1,5 В (совместимы с щелочными батареями) до 3,7 В.
Эти батареи имеют самую высокую емкость на единицу веса и длительный срок хранения. Литиевые элементы широко используются в современной портативной электронной технике: для питания часов на материнских платах компьютеров, для питания портативных медицинских приборов, наручных часов, калькуляторов, фототехники и т.д.
На графике выше показаны кривые разряда двух литиевых батарей от двух популярных производителей. Начальный ток составлял 120 мА (через резистор около 24 Ом).
Между заряженным угольным стержнем и цинковым сосудом, которые называются электродами, создается электрическое поле.
Параграф 32 – Перышкин А.В., 8 класс.
Электрический ток – это упорядоченное (направленное) движение заряженных частиц.
2 Что должно быть создано в проводнике, чтобы в нем возник и существовал ток?
Чтобы создать электрический ток в проводнике, в нем должно быть создано электрическое поле.
3. Какие преобразования энергии происходят в источнике тока?
В источнике тока преобразование механической, внутренней или другой энергии в электрическую происходит за счет разделения заряженных частиц.
4 Как устроен сухой гальванический элемент?
В гальваническом элементе происходят химические реакции, и внутренняя энергия, выделяемая в ходе этих реакций, преобразуется в электрическую энергию. Гальванический элемент состоит из цинкового сосуда (корпуса). В корпус помещается угольный стержень с металлическим колпачком. Стержень погружается в смесь оксида марганца MnO2 и измельченный углерод C. Пространство между контейнером и смесью MnO2 с C заполнен желатинообразным солевым раствором (хлорид аммония NH4Cl).
5. что такое положительная и отрицательная клеммы аккумулятора?
Во время химической реакции цинка Zn с хлоридом аммония NH4Cl, цинковый сосуд заряжен отрицательно.
Оксид марганца имеет положительный заряд, а помещенный в него угольный стержень служит для переноса положительного заряда.
Электрическое поле создается между заряженным углеродным стержнем и цинковым сосудом, которые называются электродами.
6 Как изготавливается аккумулятор?
Простейший аккумулятор состоит из двух свинцовых пластин (электродов), помещенных в раствор серной кислоты.
7. Где используются батареи?
Батареи используются для питания цепей освещения в железнодорожных вагонах, автомобилях и для запуска двигателя автомобиля. Батареи используются для питания подводных лодок под водой. Радиопередатчики и научное оборудование на спутниках питаются от батарей, установленных на спутнике.
6 Как устроен аккумуляторный блок?
Вопросы § 32
Электрический ток – это упорядоченное (направленное) движение заряженных частиц.
2. что должно быть создано в проводнике, чтобы в нем возник и существовал ток?
Для того чтобы в проводнике возник ток, в нем должно быть создано электрическое поле с помощью источников электрического тока.
3. Какие преобразования энергии происходят внутри источника тока?
Источники электрического тока преобразуют механическую, внутреннюю или другую энергию в электрическую за счет разделения заряженных частиц.
4 Как устроен сухой элемент?
Сухой гальванический элемент содержит цинковый (Zn) сосуд, внутри которого находится угольный стержень (C), помещенный в смесь оксида марганца (IV) (MnO2) и углерода, между которыми находится раствор галлатовой соли (NH4CI). Во время химической реакции цинка с хлоридом аммония цинковый сосуд заряжен отрицательно, а стержень – положительно.
5. что такое положительная и отрицательная клеммы аккумулятора?
Корпус батареи является отрицательным полюсом, а стержень – положительным.
6. Как устроен аккумулятор?
Простейший аккумулятор состоит из двух свинцовых пластин (электродов), помещенных в раствор серной кислоты. Также доступны щелочные батарейки.
7. Где используются батареи?
Аккумуляторы используются в мобильных телефонах, плеерах, ноутбуках, автомобилях, железнодорожных вагонах, подводных лодках, искусственных спутниках Земли и многих других современных устройствах.
Сухая камера
Структура гальванического элемента
Гальванический элемент – это простое устройство, с помощью которого химическая энергия преобразуется в электрическую.
Структура гальванического элемента для литиевых батарей:
- Анод при разряде отдает электроны во внешнюю цепь и окисляется в ходе электрохимической реакции. В большинстве коммерческих ячеек сегодня используются электроды на основе углерода/графита, но можно также использовать металл или сплав.
- Катод при разряде принимает электроны из внешней цепи и восстанавливается в ходе электрохимической реакции. Обычно это оксид переходного металла или фосфат.
- Электролит.
Осторожно. Структура электролита представляет собой ионный проводник, с электронным изолятором, разделяющим два электрода и обеспечивающим среду для переноса заряда в ячейке между анодом и катодом. Электролит обычно представляет собой неводный неорганический растворитель, содержащий растворенную соль лития, такую как LiPF6 в пропиленкарбонате.
Предисловие или кому адресована эта запись.
Эта запись предназначена в первую очередь для меня и тех 1,5 человек, которые интересуются наукой, в частности химией, и которые могут делать что-то полезное своими руками, а не просто ковыряться в носу и переключать каналы телевизора, лежа на диване. В результате у него мало практического применения, хотя в случае апокалипсиса этот источник электроэнергии был бы очень полезен, но он информативен с научной точки зрения.
Любители обвинять всех в бедности – идите в феврале в метель в 40-градусный мороз в лес собирать землянику, и возьмите с собой филологов и лингвистов – любителей придираться к грамматике.
Я надеюсь, что на данный момент остались только те, кто заинтересован в самостоятельном выполнении работы Калло – приятного чтения, и я надеюсь, что смогу обогатить ваш багаж знаний.
Введение.
Всегда увлекавшийся химией, в молодости он провел сотни химических экспериментов, в том числе создал химические источники электрического тока. Я не буду описывать их все, их много, и эта запись касается одного конкретного – элемента Каллота. Почему именно этот? Он довольно прост в изготовлении и не поляризуется – ЭДС в процессе не падает. Однажды я сделал такой в маленькой пробирке и не был в восторге от результата, у него был очень слабый ток, и я не нашел ему практического применения в то время. Много позже я наткнулся на упоминание об этом элементе. Он заявил, что сила тока напрямую зависит от площади поверхности электродов. Я решил проверить это. Для тех, кто очень заинтересован и не может читать дальше, ток зависит от площади поверхности электродов.
Устройство элемента.
Конструкция элемента довольно проста и схематично показана на этом рисунке.
Необходимо взять достаточно длинный сосуд.
Положительный электрод изготовлен из медной проволоки. Для этого часть медного провода очищается от изоляции и скручивается в спираль. Важно, чтобы изоляция сохранялась от змеевика до выхода из емкости, на рисунке эта часть обозначена цифрой 3. Отрицательный электрод выполнен из цинковой пластины, прикрепленной к верхней части емкости. Иллюстрация не совсем корректна. Расстояние между положительным и отрицательным электродами должно быть как можно больше, чтобы минимизировать саморазряд.
На положительный электрод, спираль из медной проволоки, насыпают CuSO4 – медный купорос слоем 1-2 см.
В качестве электролита используется 10%-ный раствор NaCl (поваренной соли).
ЭДС (электродвижущая сила или электрический ток) возникает потому, что Zn (цинк) отдает электроны Cu (меди) и растворяется в ZnSO4 (сульфате цинка). CuSO4 (сульфат меди) в свою очередь будет восстановлен Zn (цинком) до металлической меди.
ЭДС источника равна 1 В. Чтобы запитать что-либо, необходимо собрать аккумулятор из нескольких источников.
Здесь заканчивается теория и начинается практика.
Практическая сборка.
Самым сложным было найти подходящую емкость. Он должен был быть достаточно высоким и широким, чтобы вместить электроды. Он также должен был иметь крышку, чтобы вода не испарялась из него и объем электролита не уменьшался.
Я долго искал такую книгу и нашел ее случайно. Однажды меня навестила старая подруга и взяла с собой несколько бутылочек “Активии” от Danone. И вот эти бутылки оказались идеальными.
Его высота – 19 см. Она имеет широкое горлышко с пробкой. Приятным бонусом было то, что он прозрачный, его легко сложить и наблюдать за изменениями, происходящими во время элемента.
Все замечательно, но есть одно но – их всего 2, а нам нужно 3. Найти третий оказалось довольно сложно. Я купила молочко в похожей бутылке в соседнем магазине (не помню названия, это было давно, я выбросила этикетку), но бутылка была не совсем та. Это было непрозрачно.
За подходящим напитком и бутылкой мне пришлось отправиться в центр. Там было довольно много Активий, но я обнаружил, что не все они одинаково полезны. Не все ароматы имели прозрачную бутылку.
Положительный электрод был сделан из самой дешевой медной проволоки, купленной в магазине. Было приобретено три метра двухжильного провода. Я не помню поперечного сечения и не могу посмотреть на него. Сборка деталей заняла много времени, и, как следствие, я что-то забыл, что-то выбросил, например, изоляцию купленного провода.
Проволока была разрезана на 4 куска по 1,5 метра каждый. Из этих 3 частей были изготовлены 3 электрода в форме двойной спирали. Они были сделаны с помощью круглогубцев и рук, так как проволока была тонкой и легко поддавалась формовке. Для двойной спирали мне понадобилось 1,2 м очищенной проволоки.
Что произошло, можно увидеть на фотографии.
Отрицательный электрод был сделан из старых корпусов батареек АА путем припаивания проволоки к двум корпусам. Я делал оболочки, будучи подростком, много лет назад, и каким-то чудом они сохранились до сих пор.
Затем в середине колпачков сверлом 4,3 мм было просверлено отверстие для вывода проводов наружу.
Диаметр отверстия должен быть как можно меньше, чтобы через него проходили только выводы электродов, они должны держаться прочно и не провисать. Это делается как для защиты самих проводов, так и для минимизации испарения воды и уменьшения объема электролита.
Сульфат меди можно свободно приобрести в любом садовом магазине. Он поставляется в пакете или около того.
Это выглядит примерно так.
Помните, что сульфат меди довольно токсичен, поэтому необходимо соблюдать основные правила обращения с химикатами. Перчатки и противогаз не нужны, просто держите его подальше от пищи и мойте руки с мылом после работы с ним.
Для каждого элемента использовался один пакетик, 50 г. Сульфат меди насыпали на медный электрод с помощью воронки.
10% электролит был изготовлен из поваренной соли в соотношении 100 г соли на 1 л воды.
Желательно брать как можно более чистую воду. Я использую воду, очищенную двумя фильтрами, моя водопроводная вода очень богата углеводородами кальция и железа.
Необходимо использовать рафинированную поваренную соль. У меня под рукой была обычная каменная соль. После приготовления электролита я обнаружил, что в нем много примесей, и даже двойная фильтрация не очистила раствор, и он приобрел беловатый оттенок.
Одного литра раствора достаточно для 3 элементов.
Электролит следует заливать как можно осторожнее, чтобы не смешать электролит с кристаллами сульфата меди, т.е. чтобы сульфат меди не растворился. Используя ту же воронку, я залил электролит. Это было не очень точно, часть сульфата растворилась, и раствор приобрел слегка синий оттенок. Это неблагоприятно, поскольку часть меди и цинкового купороса будет потеряна в бесполезной реакции обмена CuSO4 + Zn = ZnSO4 + Cu.
Как и ожидалось, ЭДС одного элемента составила 1 В.
Ток короткого замыкания составляет 86 мА.
Я соединил 3 батареи последовательно, получив в результате 3 В, и связал изолентой для компактности.
Проверка практичности.
Батарея собрана. Для проверки практичности была куплена китайская прикроватная лампа за 45 рублей.
Для питания производитель использовал элемент CR 2032, и надо сказать, что китайские братья были настроены весьма оптимистично. Он потребляет до 33 мА и не проработает долго на стандартной батарее. Прикроватная лампа питалась от старого аккумулятора мобильного телефона емкостью 860 мАч и продержалась всего 1,5 ночи. Стоит отметить, что когда батарея достигает примерно 3 В разряда, нагрузка автоматически отключается, чтобы сохранить батарею.
Фото батареи, если кому-то интересно, конечно.
Практичность будет проверена позже. Будет проверено, сколько ночей будет работать прикроватная лампа. Стоит отметить, что ячейка не транспортабельна – ее нельзя перемещать, так как произойдет смешивание растворов и необратимый саморазряд.
О том, что возможно.
Теоретически, вместо цинка можно использовать алюминий, который более доступен.
Ошибкой может быть спаивание цинковых чашек вместе из-за возможности возникновения гальванической связи.
Если увеличить количество чашек с 2 до 3 и соответственно площадь отрицательного электрода, то можно увеличить ток, и он будет более 100 мА.
В принципе, можно даже сделать так называемый сухой элемент в качестве резервного, то есть не заливать электролит в уже собранный элемент, а доливать его, когда элемент понадобится.
Это своего рода вывод.
Собрана батарея, состоящая из 3 элементов Калло. Прилагаются максимально подробные инструкции с фотографиями.
Как уже говорилось, практичность будет оценена чуть позже. Хотя сразу видно, что гораздо практичнее и, главное, проще использовать никель-металлгидридные или литий-ионные аккумуляторы.
Напоминаю, что основная цель этого письма – понять принцип работы химических источников электрического тока на примере элемента Каллот и научиться собирать этот элемент и его практическому применению.
Спасибо за внимание. Надеюсь, этот материал был полезен.
UPD 1.
По результатам тестирования первой ночи, мне пришлось сделать батарею из 4-х элементов, так как напряжения в 3В недостаточно для того, чтобы прикроватная лампа выполняла свою работу – умеренно освещала комнату. С батареей от телефона таких проблем не было, учитывая номинальное напряжение полностью заряженной батареи 4,2 В.
UPD 2.
Вот как выглядит камера после 9 часов работы.
UPD 3.
Следующая информация не совсем о клетке Калло, но связана с химическими реактивами, используемыми для ее изготовления.
Приведенную ниже реакцию можно использовать в качестве развлечения, чтобы произвести впечатление. Например: Задайте вопрос аудитории – можно ли использовать только алюминиевую проволоку для кипячения воды? Если ответ отрицательный, покажите реакцию.
Для этого потребуется сульфат меди (CuSO4), поваренная соль (NaCl) и что-нибудь из алюминия (Al), например, проволока.
Вы берете стеклянную емкость довольно большого размера. Вы добавляете в него сульфат меди и поваренную соль. Добавьте немного больше сульфата меди и немного меньше соли. Решение готово. Можно добавить несколько капель любой кислоты, например, уксусной или несколько капель лимонной. Затем в раствор добавляют алюминий.
Это вызовет бурную реакцию с выделением водорода, вода закипит, алюминий растворится и появится металлический медный порошок.
Объяснение того, что происходит.
Алюминий – очень активный металл. Он способен растворяться в воде, выделяя водород, но в обычных условиях этому препятствует оксидный слой на его поверхности. При добавлении его к раствору сульфата меди с солью параллельно протекают 2 реакции:
1) Алюминий вступает в реакцию обмена с сульфатом меди. 3CuSO4 + Al = Al2(SO4)3 + 3Cu
2) В первой реакции нарушается целостность защитного оксидного слоя, алюминий вступает в реакцию с водой и выделяется водород. 2Al + 6H2O = 2Al(OH)3 + 3H2
Кто-нибудь заметил, что в рецептах нет поваренной соли? Это связано с тем, что он не принимает непосредственного участия в реакциях. NaCl, а точнее, ион хлора (Cl) является катализатором и не расходуется. Нет необходимости добавлять большое количество поваренной соли.
ВНИМАНИЕ! Во время реакции раствор будет кипеть и может выделяться. Выделяется водородный газ, который при смешивании с воздухом, а точнее с кислородом, образует взрывоопасные смеси. Поэтому реакция должна проводиться на открытом воздухе и с соблюдением мер предосторожности!
UPD 4.
Аккумулятор проработал 7 ночей или не менее 55 часов.
Напряжение 3,04 В. Ток короткого замыкания 102 мА. Интересно отметить, что ток увеличивается. При подключении мультиметра ток был 90 мА, через 20 секунд – уже 102 мА. Обычно ток уменьшается.
Ток, потребляемый прикроватной лампой от батареи, был меньше, чем от источника питания, и составлял всего 13 мА в пике.
После 5-й (пятой) ночи в одной из камер одна цинковая чашка отвалилась и упала на дно. Это объясняется тем, что чашки были взяты из уже использовавшихся солевых батарей и имели разный износ и, следовательно, разную толщину стенок.
50 грамм сульфата меди – это слишком много для 2 чашек цинка AA, и цинк изнашивается гораздо быстрее.
Вот как выглядит батарея после 7 ночей использования.
UPD 5.
Я решил проверить практический результат теоретически. Я знаю, что все наоборот, но мы в России! Для тех, кто торопится. Теория подтвердила практику.
В элементе происходит именно такая реакция:
CuSO4 + Zn = ZnSO4 + Cu
По формуле мы можем рассчитать молярную массу и найти процентное соотношение потребленных реактивов. Следует учесть, что мы продаем не чистый сульфат меди, а его гидрат с формулой CuSO4 * 5H2O, в результате чего его молярная масса составляет не 160, а 250.
Получается 250+65=315. В % соотношении 79% CuSO4*5H2O и 21% Zn. Оказалось, что сульфата меди нужно в 2,44 раза больше, чем цинка.
Мой вес 2 цинковых чашек составил около 4,5 г. Оказалось, что на это количество цинка мне понадобилось 17 граммов медного купороса. Оказалось, что большая часть, 30 г сульфата меди, была потрачена впустую.
Грубо говоря, на 5 г цинка требуется 20-25 г сульфата меди.
Если цинк заменить алюминием, то формула будет выглядеть следующим образом:
3CuSO4 + 2Al = Al2(SO4)3 + 3Cu
Получены другие молярные массы. 250*3 + 27*2 = 807. 93% сульфата меди и 7% алюминия. Оказалось, что сульфата меди требуется в 13,2 раза больше, чем алюминия.
В результате на 50 грамм сульфата меди требуется всего 3,8 грамма алюминия. Алюминий.
В чем смысл внезапного разговора об алюминии? У меня закончился цинк, и его нелегко достать, но есть много алюминиевой проволоки. Я уже сделал из него 4 электрода весом 28-30 г. Теоретически мне должно хватить на 5 картриджей. После растворения всего цинка в предварительно собранных элементах я построю батарею из 4 элементов, используя алюминий в качестве отрицательного электрода. Еще один ночник будет сделан с потреблением тока 100 мА от источника питания.
UPD 6.
После 14 ночей или 110 часов работы:
– напряжение 2,92 В;
– ток короткого замыкания 68 мА.
UPD 7.
После 21 ночи или 170 часов работы:
– Напряжение 2,78 В;
– Ток короткого замыкания 50 мА. В отличие от предыдущих измерений, сила тока уменьшается, ранее она увеличивалась.
Аккумулятор начал разряжаться. Интересно, продержится ли он еще неделю?
UPD 8.
После 28 ночей или 225 часов работы:
– Напряжение составляет 2,42 В;
– Ток короткого замыкания 25 мА и ниже.
Прикроватная лампа горела очень тускло. Жизнь полностью исчерпана.
В нормальном режиме прикроватная лампа работала в течение 18 ночей.
Батарея была извлечена. Цинковые чашки полностью разрушились, хотя и сохранили свою форму. На медном положительном электроде образовалось много меди, что сделало невозможным извлечение электрода из чашки. Полностью удалить образовавшуюся медь с электрода не удалось.
UPD 9.
Батарея была собрана.
Спиралевидные отрицательные электроды были изготовлены из алюминиевой проволоки диаметром 2 мм весом 30 г. В качестве положительных электродов использовались те же медные электроды, что и в первой батарее. Было использовано такое же количество сульфата меди, 50 г на ячейку.
Алюминиевые электроды не показали ожидаемых результатов.
Напряжение на ячейку составляет 0,68 В. Ток короткого замыкания составляет 60 мА и увеличивается.
Мне пришлось собрать 4 ячейки. Результат – всего 2,7 В и 75 мА возрастающего тока короткого замыкания.
Алюминий частично реагирует с водой, в результате чего водород выдавливается из электролита через проволочное отверстие в крышке.
Батарейка будет использоваться с тем же ночником.
Проверьте, как долго прослужит эта батарея.
UPD 9.
Пытаюсь понять, почему теория и практика не совпадают.
Мои теоретические расчеты были основаны на этой таблице электродных потенциалов.
Это дало потенциал меди + 0,34 и цинка + 0,76, так что теоретически я получил 1,1 В, и практика это подтвердила. Алюминий имеет потенциал – 1,66, который в сочетании с потенциалом меди + 0,34 должен был дать 2 В, но на практике он дал едва 0,7 В.
Немного погуглив, я нашел эту таблицу потенциалов.
По ее данным, потенциал для Нейтрального: Медь 0,06, цинк 0,78, алюминий 0,57. Для пары цинк-медь теория дает только 0,84 В против фактических 1,02. Пара алюминий-медь дает теоретическое значение 0,63 В, что очень близко к практическому значению 0,69 В. Если взять потенциал для кислой среды, то получится: медь 0,15, цинк 0,84 и алюминий 0,5. Если взять потенциалы для кислой среды, то получим: медь 0,15, цинк 0,84 и алюминий 0,5. В результате теоретические данные для обеих пар согласуются с практическими данными.
UPD 10.
Батарея с алюминиевыми отрицательными электродами проработала 10 ночей или 80 часов.
Напряжение составляет 2,97 В.
Ток короткого замыкания 90 мА или более.
В первую ночь прикроватная лампа работала очень плохо из-за поляризации алюминиевого электрода, вызванной образованием на нем водорода. Во вторую и последующие ночи прикроватная лампа работает идеально.
Напряжение одной ячейки на алюминиевых отрицательных электродах составляет 0,74 В, что не укладывается в рамки теоретического расчета.
У меня есть сомнения.
Дальнейшие измерения будут проводиться с интервалом в 5 дней.
UPD 11.
После 15 ночей или 120 часов работы:
– Напряжение 2,98 В;
– Ток короткого замыкания 95 мА и более.
UPD 12.
После 20 ночей или 160 часов работы:
– Напряжение 2,96 В;
– Ток короткого замыкания 94 мА и увеличивается.
UPD 13.
После 25 ночей или 200 часов работы:
– Напряжение 2,95 В;
– Ток короткого замыкания 95 мА и выше.
UPD 14.
После 30 ночей или 240 часов работы:
– Напряжение 2,96 В;
– Ток короткого замыкания 95 мА и выше.
UPD 15.
После 35 ночей или 280 часов работы:
– Напряжение 2,89 В;
– Ток короткого замыкания 90 мА и выше.
UPD 16.
После 40 ночей или 320 часов работы:
– Напряжение 2,85 В;
– Ток короткого замыкания 90 мА и выше.
UPD 17.
После 45 ночей или 360 часов работы:
– Напряжение 2,83 В;
– Ток короткого замыкания 90 мА и выше.
UPD 18.
После 50 ночей или 400 часов работы:
– Напряжение составляет 2,81 В;
– ток короткого замыкания 90 мА и более.
UPD 19.
После 55 ночей или 440 часов работы:
– Напряжение 2,79 В;
– Ток короткого замыкания 65 мА.
Медный купорос полностью износился.
UPD 20.
Для сравнения производительности самодельной батарейки были куплены 2 солевые батарейки R20, всего 47 рублей за все.
Батарея была собрана.
Время работы 0 ночей, 0 часов:
– напряжение 3,32 В;
– ток короткого замыкания 3300 мА.
UPD 21.
Благодаря использованию батареи R20 яркость прикроватной лампы в первую ночь увеличилась в 2 раза. На третью ночь яркость не была значительно выше, чем при использовании элементов CALLO с батарейным питанием.
Время работы 5 ночей, 35 часов:
– напряжение 2,91 В;
– ток короткого замыкания 2600 мА.
UPD 22.
Время работы 10 ночей, 70 часов:
– Напряжение 2,82 В;
– Ток короткого замыкания 1600 мА.
UPD 23.
Время работы 15 ночей, 105 часов:
– Напряжение 2,79 В;
– Ток короткого замыкания 1500 мА.
UPD 24.
Время работы 20 ночей, 140 часов:
– Напряжение 2,74 В;
– Ток короткого замыкания 1300 мА.
UPD 25.
Время работы 25 суток, 175 часов:
– Напряжение 2,71 В;
– Ток короткого замыкания 1200 мА.
UPD 26.
Время работы 30 ночей, 210 часов:
– Напряжение 2,68 В;
– ток короткого замыкания 1150 мА.
UPD 27.
Время работы 35 ночей, 245 часов:
– напряжение 2,64 В;
– Ток короткого замыкания 1100 мА.
С приветствием от StrateG aka Шестаков Алексей.
Ячейка Каллота
Предисловие или кому адресована эта заметка.
Этот диск в первую очередь предназначен для меня и тех 1,5 человек, которые интересуются наукой, особенно химией, и которые могут делать что-то полезное своими руками, а не просто ковыряться в носу и переключать каналы телевизора, лежа на диване. В результате, вряд ли это практично, хотя в случае апокалипсиса этот источник электроэнергии был бы очень полезен, но зато он научно информативен.
Если вы любите обвинять других в бедности, то выйдите в лес в феврале, в метель, в 40-градусный мороз, соберите землянику и возьмите с собой филологов и лингвистов, которые любят придираться к вашей грамматике.
Я надеюсь, что к этому моменту остались только те, кто заинтересован в изготовлении элемента Каллота вручную – приятного чтения, и я надеюсь, что смогу обогатить ваш багаж знаний.
Введение.
Всегда увлекавшийся химией, в молодости он провел сотни химических экспериментов, в том числе создал химические источники электрического тока. Я не буду описывать их все, их много, и эта запись касается одного конкретного – элемента Каллота. Почему именно этот? Он довольно прост в изготовлении и не поляризуется – ЭДС не спадает во время работы. Однажды я сделал это в небольшой пробирке и не был в восторге от результата, ток был очень мал, и я не нашел ему практического применения. Много позже я наткнулся на упоминание об этом элементе. Он заявил, что ток напрямую связан с поверхностью электродов. Я решил проверить это. Для тех, кто очень интересуется и не может читать дальше, значение тока на самом деле зависит от поверхности электродов.
Элементное устройство.
Конструкция элемента довольно проста и схематично показана на этом рисунке.
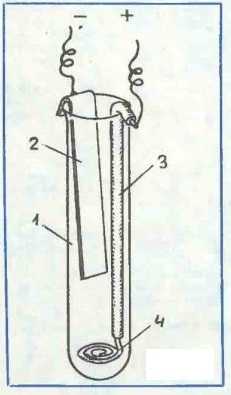
Необходимо взять достаточно длинный сосуд.
Положительный электрод изготовлен из медной проволоки. Для этого часть медного провода очищается от изоляции и скручивается в спираль. Важно, чтобы изоляция сохранялась от змеевика до выхода из емкости, на рисунке эта часть обозначена цифрой 3. Отрицательный электрод выполнен из цинковой пластины, прикрепленной к верхней части емкости. Иллюстрация не совсем корректна. Расстояние между положительным и отрицательным электродами должно быть как можно больше, чтобы минимизировать саморазряд.
На положительный электрод слоем 1-2 см насыпают медную проволочную спираль, CuSO4 – медный купорос.
В качестве электролита используется 10%-ный раствор NaCl (поваренной соли).
ЭДС (электродвижущая сила или электрический ток) возникает потому, что Zn (цинк) отдает электроны Cu (меди) и растворяется в ZnSO4 (сульфате цинка). CuSO4 (сульфат меди) в свою очередь будет восстановлен Zn (цинком) до металлической меди.
ЭДС источника равна 1 В. Чтобы запитать что-либо, необходимо собрать аккумулятор из нескольких источников.
Здесь заканчивается теория и начинается практика.
Практическая сборка.
Самым сложным было найти подходящую емкость. Он должен был быть высоким и иметь широкую горловину, чтобы в него можно было поместить электроды. Он также должен иметь крышку, чтобы предотвратить испарение воды и уменьшение объема электролита.
Я долго искал и нашел его случайно. В гости пришел старый друг и принес несколько бутылок “Активии” от Danone. И эти бутылки оказались идеальными.

Его высота – 19 см. Она имеет широкое горлышко с пробкой. Приятным бонусом было то, что он был прозрачным, его легко было собрать и наблюдать за изменениями в процессе работы.
Все замечательно, но есть одно но – их всего 2, а нам нужно 3. Найти третий оказалось довольно сложно. В соседнем магазине я купила молочко в похожей бутылке (название не помню, это было давно, этикетку я выбросила), но бутылка была не совсем та. Это было непрозрачно.

За подходящим напитком и бутылкой мне пришлось отправиться в центр. Там было довольно много Активий, но я обнаружил, что не все они одинаково полезны. Не все ароматы имели прозрачную бутылку.
Положительный электрод был сделан из самой дешевой медной проволоки, купленной в магазине. Было приобретено три метра двужильного провода. Я не помню поперечного сечения и не могу его увидеть. Сборка деталей заняла много времени, поэтому кое-что я забыл, а кое-что выбросил, например, изоляцию купленного провода.
Проволока была разрезана на 4 куска по 1,5 м каждый. Из этих 3 частей были изготовлены 3 электрода в форме двойной спирали. Они были сделаны с помощью круглогубцев и рук, так как проволока была тонкой и легко поддавалась формовке. Для двойной спирали мне понадобилось 1,2 м очищенной проволоки.
Что произошло, можно увидеть на фотографии.

Отрицательный электрод был сделан из старых корпусов батареек АА путем припаивания проволоки к двум корпусам. Я сделал оболочки много лет назад, когда был подростком, и каким-то чудом они сохранились до сих пор.

Затем в центре колпачков сверлом диаметром 4,3 мм было просверлено отверстие, через которое были пропущены провода.

Диаметр отверстия должен быть как можно меньше, чтобы через него проходили только электродные провода, они должны прочно удерживаться на месте и не шататься. Это необходимо для защиты проводов, минимизации испарения воды и уменьшения объема электролита.

Сульфат меди можно свободно купить в любом садовом магазине. Он поставляется в пакете или около того.

Это выглядит примерно так.

Помните, что сульфат меди довольно токсичен, поэтому необходимо соблюдать основные правила обращения с химикатами. Перчатки и противогаз не нужны, просто держите его подальше от пищи и мойте руки с мылом после работы с ним.
Для каждого элемента использовался один пакетик, 50 г. Сульфат меди насыпали на медный электрод сверху с помощью воронки.

Электролит из 10% поваренной соли был сделан из расчета на 100 г. соли на 1 литр воды.
Вода должна быть как можно более чистой. Я использую воду, очищенную двумя фильтрами; в моей водопроводной воде много бикарбонатов кальция и железа.
Необходимо использовать рафинированную поваренную соль. У меня под рукой была обычная каменная соль. После приготовления электролита оказалось, что в нем много примесей, и даже двойная фильтрация не очистила раствор, и он имел беловатый оттенок.
Одного литра раствора достаточно для 3 элементов.
Электролит следует заливать как можно осторожнее, чтобы не смешать электролит с кристаллами сульфата меди, т.е. чтобы сульфат меди не растворился. Используя ту же воронку, я залил электролит. Это было не очень точно, часть сульфата растворилась, и раствор приобрел слегка синий оттенок. Это неблагоприятно, поскольку часть медно-цинкового купороса будет потеряна в бесполезной реакции обмена CuSO4 + Zn = ZnSO4 + Cu.
Как и ожидалось, ЭДС одной ячейки составила 1 В.

Ток короткого замыкания 86 мА.

Подключил 3 батареи последовательно, чтобы получить 3 В, и склеил изоленты вместе для компактности.

Проверка практичности.
Батарея собрана. Чтобы проверить практичность, был куплен китайский ночник за 45 рублей.

Для питания производитель использовал элемент CR 2032, и надо сказать, что китайские братья были настроены весьма оптимистично. Он потребляет ток до 33 мА и не сможет долго работать от стандартной батареи. Прикроватная лампа питалась от старого аккумулятора мобильного телефона емкостью 860 мАч и продержалась всего 1,5 ночи. Стоит отметить, что когда батарея достигает примерно 3 В разряда, нагрузка автоматически отключается, чтобы сохранить батарею.
Фото батареи, если кому-то интересно, конечно.

Практичность будет проверена позже. Будет проверено, сколько ночник будет работать. Стоит отметить, что ячейка не транспортабельна – ее нельзя перемещать, так как произойдет смешивание растворов и необратимый саморазряд.
Что вполне возможно.
Теоретически вместо цинка можно было бы использовать алюминий – он более доступен.
Вероятно, спаивание цинковых чашек вместе было ошибкой из-за возможной гальванической связи.
Если увеличить количество чашек с 2 до 3 и соответственно площадь отрицательного электрода, то можно увеличить ток, и он будет более 100 мА.
В принципе, можно даже сделать так называемый сухой элемент в качестве резервного, то есть не заливать электролит в уже собранный элемент, а доливать его, когда элемент понадобится.
Это своего рода вывод.
Собрана батарея, состоящая из 3 элементов Калло. Прилагаются максимально подробные инструкции с фотографиями.
Как уже говорилось, практичность будет оценена чуть позже. Хотя сразу видно, что гораздо практичнее и, прежде всего, проще использовать никель-гидридные или литий-ионные аккумуляторы или батареи.
Напоминаю, что основная цель этого письма – понять принцип работы химических источников электричества на примере элемента Каллота и научиться собирать этот элемент и применять его на практике.
Спасибо за внимание. Я надеюсь, что этот материал был полезен.
UPD 1.
По результатам первого ночного теста мне пришлось сделать 4-элементную батарею, потому что 3 В недостаточно для того, чтобы прикроватная лампа выполняла свою работу – умеренно освещала комнату. С батареей от телефона таких проблем не было, учитывая номинальное напряжение полностью заряженной батареи 4,2 В.
UPD 2.
Вот как выглядит камера после 9 часов работы.

UPD 3.
Эта информация относится не к самому элементу Каллот, а к химическим реактивам, используемым для его получения.
Следующую реакцию можно использовать в качестве развлечения, чтобы произвести впечатление. Например: Спросите аудиторию, можно ли вскипятить воду, используя только алюминиевую проволоку. Если ответ “нет”, продемонстрируйте реакцию.
Вам понадобится сульфат меди (CuSO4), поваренная соль (NaCl) и что-нибудь из алюминия (Al), например, проволока.
Вы берете стеклянную емкость довольно большого размера. Вы добавляете в него сульфат меди и поваренную соль. Добавьте немного больше сульфата меди и немного меньше соли. Решение готово. Можно добавить несколько капель любой кислоты, например, уксусной или несколько капель лимонной. Затем в раствор добавляют алюминий.
Начнется бурная реакция с выделением водорода, вода закипит, алюминий растворится и появится металлический медный порошок.
Объяснение происходящего.
Алюминий – очень активный металл. Он способен растворяться в воде, выделяя водород, но в обычных условиях этому препятствует оксидный слой на его поверхности. При добавлении его в раствор медного купороса и соли параллельно протекают две реакции:
1) Алюминий вступает в реакцию обмена с сульфатом меди. 3CuSO4 + Al = Al2(SO4)3 + 3Cu
2) В первой реакции нарушается целостность защитного оксидного слоя, алюминий вступает в реакцию с водой и выделяется водород. 2Al + 6H2O = 2Al(OH)3 + 3H2
Кто-нибудь заметил, что в рецептах нет поваренной соли? Это связано с тем, что он не принимает непосредственного участия в реакциях. NaCl, а точнее, ион хлора (Cl) является катализатором и не расходуется. Не нужно добавлять слишком много поваренной соли.
ВНИМАНИЕ! Во время реакции раствор закипает и может быть выброшен. Выделяется водородный газ, который при смешивании с воздухом, а точнее с кислородом, образует взрывоопасную смесь. Поэтому реакцию необходимо проводить на открытом воздухе, соблюдая правила безопасности!
UPD 4.
Аккумулятор проработал 7 ночей или не менее 55 часов.
Напряжение 3,04 В. Ток короткого замыкания 102 мА. Интересно отметить, что ток увеличивается. При подключении мультиметра ток составлял 90 мА, через 20 секунд – уже 102 мА. Обычно ток уменьшается.
Ток потребления ночника от батареи был меньше, чем от источника питания, и составлял всего 13 мА в пике.
После 5-й (пятой) ночи в одной из камер одна цинковая чашка отвалилась и упала на дно. Это связано с тем, что чашки были взяты из использованных соляных камер и имели разный уровень износа и, следовательно, разную толщину стенок.
50 гр. Сульфата меди слишком много для 2 цинковых чашек батареек АА, цинк будет израсходован гораздо быстрее.
Вот как выглядит батарея после 7 ночей использования.

UPD 5.
Я решил проверить практический результат теоретически. Я знаю, что все наоборот, но мы в России! Для тех, кто торопится. Теория подтвердила практику.
В элементе происходит следующая реакция:
CuSO4 + Zn = ZnSO4 + Cu
По формуле можно рассчитать молярную массу и найти процентное соотношение расходуемых реагентов. Следует учитывать, что мы продаем не чистый сульфат меди, а его гидрат с формулой CuSO4 * 5H2O, в результате чего его молярная масса составляет не 160, а 250.
Получается 250+65=315. В % соотношении 79% CuSO4*5H2O и 21% Zn. Оказалось, что сульфата меди нужно в 2,44 раза больше, чем цинка.
Мой вес 2 цинковых чашек составил около 4,5 г. Оказалось, что на это количество цинка требуется 17 граммов медного купороса. Оказалось, что я потратил большую часть из 30 граммов медного купороса.
Грубо говоря, на 5 граммов цинка нужно 20-25 граммов медного купороса.
Если цинк заменить алюминием, то формула будет выглядеть следующим образом:
3CuSO4 + 2Al = Al2(SO4)3 + 3Cu
Получены другие молярные массы. 250*3 + 27*2 = 807. 93% сульфата меди и 7% алюминия. Оказалось, что сульфата меди в 13,2 раза больше, чем алюминия.
В результате 50 г сульфата меди занимают всего 3,8 г. Алюминий.
В чем смысл внезапного разговора об алюминии? У меня закончился цинк, и его нелегко достать, но есть много алюминиевой проволоки. Я уже сделал из него 4 электрода весом 28-30 г. Теоретически мне должно хватить на 5 картриджей. После растворения всего цинка в предварительно собранных элементах я построю батарею из 4 элементов, используя алюминий в качестве отрицательного электрода. Еще один ночник будет сделан с потреблением тока 100 мА от источника питания.
UPD 6.
После 14 ночей или 110 часов работы:
– Напряжение 2,92 В;
– Ток короткого замыкания 68 мА.
UPD 7.
После 21 ночи или 170 часов работы:
– Напряжение 2,78 В;
– Ток короткого замыкания 50 мА. В отличие от предыдущих измерений, сила тока уменьшается, ранее она увеличивалась.
Аккумулятор начал разряжаться. Интересно, продержится ли он еще неделю?
UPD 8.
После 28 ночей или 225 часов использования:
– напряжение составляет 2,42 В;
– ток короткого замыкания 25 мА и ниже.
Прикроватная лампа горела очень тускло. Срок жизни полностью исчерпан.
В нормальном режиме прикроватная лампа проработала 18 ночей.
Батарея была извлечена. Цинковые чашки полностью разрушились, хотя и сохранили свою форму. На медном положительном электроде образовалось много меди, что сделало невозможным извлечение электрода из чашки. Полностью удалить образовавшуюся медь с электрода не удалось.
UPD 9.
Батарея была собрана.
Отрицательные электроды были изготовлены из алюминиевой проволоки диаметром 2 мм в виде спирали весом 30 г. Положительные электроды были теми же медными электродами, которые использовались в первой батарее. Было использовано такое же количество сульфата меди, 50 г на ячейку.
Алюминиевые электроды не показали ожидаемых результатов.
Напряжение одной ячейки составляет 0,68 В. Ток короткого замыкания 60 мА и более.
Мне пришлось собрать 4 ячейки. Результат – всего 2,7 В и 75 мА возрастающего тока короткого замыкания.
Алюминий частично реагирует с водой, в результате чего водород выдавливается из электролита через проволочное отверстие в крышке.
Батарея будет использоваться с одной прикроватной лампой.
Проверьте, как долго прослужит эта батарея.
UPD 9.
Пытаюсь понять, почему теория и практика не совпадают.
Мои теоретические расчеты были основаны на этой таблице электродных потенциалов.
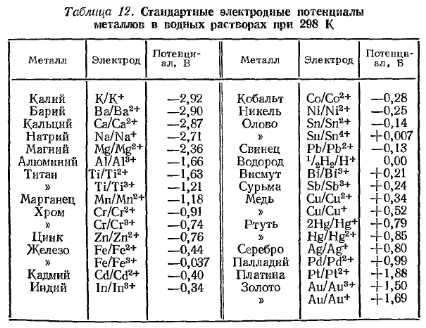
Согласно ему потенциал меди + 0,34, цинка – 0,76, что дает 1,1 В в теории, что и подтвердилось на практике. Алюминий имеет потенциал 1,66, что в сочетании с потенциалом меди + 0,34 должно дать 2 В, но на практике едва получилось 0,7 В.
Немного погуглив, я нашел эту таблицу потенциалов.
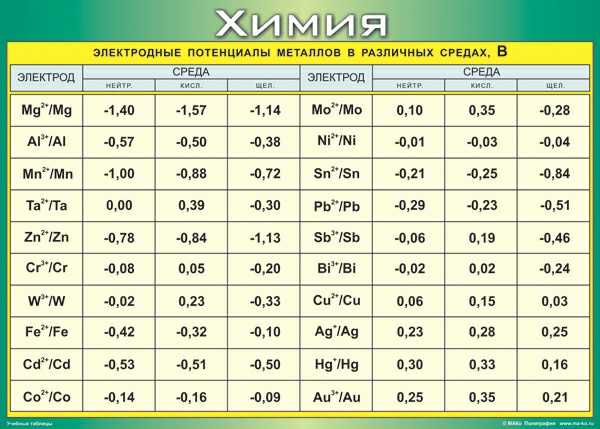
По ее данным, потенциал для Нейтрального: Медь – 0.06, цинк – 0.78, алюминий – 0.57. Для пары цинк-медь теория дает только 0.84 В по сравнению с фактическим значением 1.02. Пара алюминий-медь дает теоретическое значение 0.63 В, что очень близко к практическому значению 0.69 В. Если взять потенциалы для кислой среды, то получим: медь 0,15, цинк 0,84 и алюминий 0,5. В результате теоретические данные обеих пар согласуются с практическими данными.
UPD 10.
Батарея с алюминиевыми отрицательными электродами проработала 10 ночей или 80 часов.
Напряжение составляет 2,97 В.
Ток короткого замыкания составляет 90 мА и увеличивается.
В первую ночь прикроватная лампа работала очень плохо из-за поляризации алюминиевого электрода, вызванной образованием на нем водорода. Во вторую и последующие ночи прикроватная лампа работает идеально.
Напряжение одной ячейки на алюминиевых отрицательных электродах составляет 0,74 В, что не вписывается в теоретические расчеты.
У меня нет слов.
Дальнейшие измерения будут проводиться с интервалом в 5 ночей.
UPD 11.
После 15 ночей или 120 часов работы:
– напряжение 2,98 В;
– ток короткого замыкания 95 мА и более.
UPD 12.
После 20 ночей или 160 часов работы:
– Напряжение 2,96 В;
– Ток короткого замыкания 94 мА и увеличивается.
UPD 13.
После 25 ночей или 200 часов работы:
– Напряжение 2,95 В;
– Ток короткого замыкания 95 мА или более.
UPD 14.
После 30 ночей или 240 часов работы:
– Напряжение 2,96 В;
– Ток короткого замыкания 95 мА и выше.
UPD 15.
После 35 ночей или 280 часов работы:
– Напряжение составляет 2,89 В;
– ток короткого замыкания 90 мА и выше.
UPD 16.
После 40 ночей или 320 часов работы:
– Напряжение 2,85 В;
– Ток короткого замыкания 90 мА и выше.
UPD 17.
После 45 ночей или 360 часов работы:
– Напряжение 2,83 В;
– Ток короткого замыкания 90 мА и выше.
UPD 18.
После 50 ночей или 400 часов работы:
– Напряжение 2,81 В;
– Ток короткого замыкания 90 мА и выше.
UPD 19.
После 55 ночей или 440 часов работы:
– Напряжение 2,79 В;
– Ток короткого замыкания 65 мА.
Медный купорос полностью износился. 
UPD 20.
Для сравнения характеристик самодельных батареек были куплены 2 солевые батарейки R20, всего 47 рублей за все. 
Батарея была собрана.
Время работы 0 ночей, 0 часов:
– напряжение 3,32 В;
– ток короткого замыкания 3300 мА.
UPD 21.
Благодаря использованию батареи R20 яркость прикроватной лампы в первую ночь увеличилась в 2 раза. На третью ночь яркость не была значительно выше, чем при использовании элементов Каллота с батарейным питанием.
Время работы 5 ночей, 35 часов:
– напряжение 2,91 В;
– ток короткого замыкания 2600 мА.
UPD 22.
Время работы 10 ночей, 70 часов:
– Напряжение 2,82 В;
– Ток короткого замыкания 1600 мА.
UPD 23.
Время работы 15 ночей, 105 часов:
– Напряжение 2,79 В;
– Ток короткого замыкания 1500 мА.
UPD 24.
Время работы 20 ночей, 140 часов:
– Напряжение 2,74 В;
– Ток короткого замыкания 1300 мА.
UPD 25.
Время работы 25 суток, 175 часов:
– Напряжение 2,71 В;
– Ток короткого замыкания 1200 мА.
UPD 26.
Время работы 30 ночей, 210 часов:
– напряжение 2,68 В;
– Ток короткого замыкания 1150 мА.
UPD 27.
Время работы 35 ночей, 245 часов:
– Напряжение 2,64 В;
– Ток короткого замыкания 1100 мА.
С приветствием от StrateG aka Шестаков Алексей.Как работает гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½ CuSO4 ½ Cu? Во время работы, когда электрическая цепь замкнута, металлический цинк окисляется.
Типы гальванических элементов
Наиболее распространенными считаются углеродно-цинковые элементы. Они имеют пассивный углеродный коллектор, который находится в контакте с анодом, состоящим из оксида марганца (4). Электролитом является хлорид аммония, который используется в виде пасты.
Она не течет, поэтому сам гальванический элемент называется сухим элементом. Их особенностью является способность к “регенерации” в процессе эксплуатации, что положительно сказывается на сроке их службы. Гальванические элементы недороги, но не очень эффективны. При понижении температуры их эффективность снижается, а при повышении температуры электролит постепенно высыхает.
Щелочные элементы используют щелочной раствор и поэтому имеют множество применений.
В литиевых элементах анод является активным металлом, что положительно сказывается на сроке службы. Литий имеет отрицательный электродный потенциал, поэтому при небольших размерах эти элементы имеют максимальное номинальное напряжение. Недостатком таких систем является высокая цена. Вскрытие литиевых блоков питания чревато взрывом.
Читайте далее:- Что такое электродный потенциал; Школа для инженеров-электриков: электротехника и электроника.
- Электролит (химия) – это. Что такое электролит (химия)?.
- Тонкости электропроводности.
- Как работает pH-электрод.
- 5 причин, почему лампочки часто перегорают в вашей квартире и что делать?.
- Электрический ток в электролитах.
- Какой металл лучше всего проводит электричество? 7 букв, первая буква С – кроссворды и сканворды.